Фармакологические свойства препарата Лефлуномид
базисный противоревматический препарат, обладающий антипролиферативными, иммунодепрессивными и противовоспалительными свойствами. Активный метаболит лефлуномида — А771726 ингибирует фермент дегидрооротатдегидрогеназу и проявляет антипролиферативную активность. А771726 in vitro тормозит вызванную митогенами пролиферацию и синтез ДНК Т-лимфоцитов. Антипролиферативная активность А771726 проявляется, по-видимому, на уровне биосинтеза пиримидина, поскольку добавление в клеточную культуру уридина устраняет тормозящее действие метаболита А771726. С использованием радиоизотопных лигандов показано, что А771726 избирательно связывается с дегидрооротатдегидрогеназой, чем объясняется его свойство угнетать этот фермент и пролиферацию лимфоцитов на стадии G1. Пролиферация лимфоцитов является одним из ключевых этапов развития ревматоидного артрита. Одновременно А771726 тормозит экспрессию рецепторов к интерлейкину-2 и антигенов ядра Ki-67 и PCNA, связанных с клеточным циклом. Терапевтический эффект обычно проявляется через 4–6 нед и может нарастать в дальнейшем в течение 4–6 мес. Лефлуномид быстро превращается в активный метаболит — А771726 (первичный метаболизм осуществляется в кишечнике и печени). В плазме, моче или кале обнаруживаются следовые количества неизмененного лефлуномида. Единственным определяемым метаболитом является А771726, ответственный за основные свойства препарата in vivo. При приеме внутрь абсорбция составляет 82–95%. Максимальная концентрация А771726 достигается через 1–24 ч после однократно принятой дозы. Прием пищи не влияет на абсорбцию препарата. В дозе 5–25 мг фармакокинетические параметры А771726 имеют линейную зависимость. В дозе 20 мг в сутки средние плазменные концентрации А771726 при равновесном состоянии имели значение 35 мкг/мл. А771726 быстро связывается с альбуминами. Несвязанная фракция А771726 — 0,2%. Связь с белками А771726 более вариабельна и несколько снижается у больных ревматоидным артритом или с ХПН. Лефлуномид метаболизируется до одного главного (А771726) и нескольких второстепенных метаболитов, включая 4-трифторметилаланин. Выводится А771726 медленно, клиренс составляет 31 мл/ч. Период полувыведения — 2 нед. У больных с ХПН период полувыведения удлиняется.
Лефлуномид в лечении ревматоидного артрита
РА приводит к снижению качества жизни пациентов и ранней инвалидизации. Так, почти 50% больных РА становятся инвалидами в течение 5 лет заболевания, а 10% – в течение первых 2 лет болезни. Продолжительность жизни больных РА, согласно данным проспективных исследований, уменьшается в связи с поражением различных органов и систем [1–3]. Лечение РА основано на применении базисных противовоспалительных препаратов (БПВП). К БПВП относят группу различных по химической структуре лекарственных средств, объединяемых способностью «модифицировать» течение РА, приводя к стойкому уменьшению активности заболевания, замедлению темпов рентгенологического прогрессирования и достижению клинико–лабораторной ремиссии [1,2]. Основными базисными препаратами для лечения РА является лефлуномид и метотрексат. Различаются подходы к назначению этих препаратов. Согласно рекомендациям АСR, оба препарата являются препаратами 1-го выбора при стартовой терапии РА. В то же время разработанные EULAR рекомендации предлагают начинать терапию с назначения метотрексата, а при его непереносимости или неэффективности использовать лефлуномид. Арава® (лефлуномид) принадлежит к классу базисных противоревматических препаратов и обладает антипролиферативными, иммуномодулирующими, иммуносупрессивными и противовоспалительными свойствами. Активный метаболит лефлуномида А771726 ингибирует фермент дегидрооротат дегидрогеназу и обладает антипролиферативной активностью. А771726 в условиях in vitro тормозит вызванную митогенами пролиферацию и синтез ДНК Т–лимфоцитов. Антипролиферативная активность А771726 проявляется, по–видимому, на уровне биосинтеза пиримидина, поскольку добавление в клеточную культуру уридина устраняет тормозящее действие метаболита А771726. С использованием радиоизотопных лигандов показано, что А771726 избирательно связывается с ферментом дегидрооротат дегидрогеназой, чем объясняется его свойство тормозить этот фермент и пролиферацию лимфоцитов на стадии G1. Пролиферация лимфоцитов является одним из ключевых этапов развития РА. Одновременно А771726 тормозит экспрессию рецепторов к интерлейкину–2 (СВ–25) и антигенов ядра Ki–67 и PCNA, связанных с клеточным циклом. Терапевтическое действие лефлуномида было показано на нескольких экспериментальных моделях аутоиммунных заболеваний, включая РА. Лефлуномид (Арава®) уменьшает симптомы и замедляет прогрессирование поражения суставов при активной форме РА. Терапевтический эффект обычно проявляется через 4–6 нед. и может нарастать в дальнейшем на протяжении 4–6 мес. Лефлуномид быстро превращается в свой активный метаболит А771726 (первичный метаболизм в кишечной стенке и печени). В плазме, моче или кале были замечены лишь следовые количества неизмененного лефлуномида. Единственным определяемым метаболитом, ответственным за основные свойства препарата in vivo, является А771726. При приеме внутрь абсорбируется 82–95% препарата. Максимальные плазменные концентрации А771726 определяются в течение 1–24 ч после однократно принятой дозы. Лефлуномид может приниматься вместе с пищей. Из–за очень длительного периода полувыведения А771726 (около 2 нед.) использовалась нагрузочная доза 100 мг в сут. в течение 3 дней. Это позволило быстро достигнуть равновесного состояния плазменной концентрации А771726. Без нагрузочной дозы для достижения равновесной концентрации потребовался бы 2–месячный прием препарата. В исследованиях с многократным назначением препарата фармакокинетические параметры А771726 были дозозависимыми в диапазоне доз от 5 до 25 мг. В этих исследованиях клинический эффект был тесно связан с плазменной концентрацией А771726 и суточной дозой лефлуномида. При дозе 20 мг в сут. средние плазменные концентрации А771726 при равновесном состоянии имели значение 35 мкг/мл. В плазме происходит быстрое связывание А771726 с альбуминами. Несвязанная фракция А771726 составляет примерно 0,62%. Связывание А771726 более вариабельно и несколько снижается у больных РА или пациентов с хронической почечной недостаточностью. Надо отметить, что оригинальный препарат лефлуномида (Арава®) уже содержит некоторое количество активного метаболита, процентное содержание которого запатентовано. Доказательства клинической эффективности и безопасности получены именно в отношении оригинального препарата (Арава®). Основываясь на данном факте, можно предположить, что терапевтическая эффективность оригинального препарата лефлуномида может превосходить таковую генерика. Лефлуномид метаболизируется до одного главного (А771726) и нескольких второстепенных метаболитов, включая 4–трифлюорометилаланин. Биотрансформация лефлуномида в А771726 и последующий метаболизм самого А771726 контролируются несколькими ферментами и происходят в микросомальных и других клеточных фракциях. Исследования взаимодействия с циметидином (неспецифическим ингибитором цитохрома Р450) и рифампицином (неспецифическим индуктором цитохрома Р450) показали, что in vivo СYP–энзимы вовлечены в метаболизм лефлуномида только в незначительной степени. Выведение А771726 из организма медленное и характеризуется клиренсом 31 мл/ч. Лефлуномид выводится с фекалиями (вероятно, за счет билиарной экскреции) и мочой. Период полувыведения составляет около 2 нед. Фармакокинетика А771726 у пациентов, находящихся на ХАПД, подобна таковой у здоровых добровольцев. Более быстрое выведение А771726 наблюдается у пациентов, находящихся на гемодиализе, что связано не с экстракцией препарата в диализат, а с вытеснением его из связи с белком. Хотя клиренс А771726 увеличивается приблизительно в 2 раза, конечный период полувыведения является подобным таковому у здоровых лиц, т. к. одновременно увеличивается объем распределения [3,4,13]. Данные метаанализа основных рандомизированных плацебо–контролируемых исследований (РПКИ), касающихся эффективности лефлуномида при РА, суммированы в таблицах 1 и 2 [5–11]. В исследование III фазы были включены 1817 пациентов с РА. Исходные демографические данные и число пациентов в исследовании приведены в таблице 1 [4–10]. По данным этих исследований была проанализирована сравнительная оценка эффективности лефлуномида в группе пациентов, получавших метотрексат и сульфасалазин. По результатам метаанализа опубликованных исследований по лефлуномиду, ACR–ответ был лучше в группе пациентов, получавших лефлуномид, чем в группе пациентов, получавших плацебо. На 6 мес. и 12 мес. соответственно ACR20 (20% улучшение в соответствии с критериями ACR) достигли 60 и 53% пациентов, получавших лефлуномид, и 27 и 26% пациентов из группы плацебо. Точно так же ACR50 (50% улучшение в соответствии с критериями ACR) было отмечено у 29 и 34% пациентов, получавших лефлуномид, и у 11 и 8% из группы плацебо в тех же точках. В группе пациентов, получавших лефлуномид, наблюдалось значительное снижение индекса HAQ на 0,37 (95% доверительный интервал (ДИ) 0,33, 0,41) в течение 12 мес., а по сравнению с увеличением в группе плацебо – на 0,06 (95% ДИ 0,03, 0,16). Сопоставимые результаты терапии лефлуномидом наблюдались у пациентов, принимавших сульфасалазин и метотрексат в течение 2–летнего исследования, показали более значимое снижение индекса HAQ в группе пациентов, получавших лефлуномид. Также анализ индекса Sharp показал значительно меньшую радиологическую прогрессию в группе лефлуномида, чем в группе плацебо (лефлуномид по сравнению с плацебо: 6–месячное исследование, p=0,0004; 12–месячное исследование, р = 0,0007) [5–11]. В исследовании MN302 оценивались эффективность и безопасность применения лефлуномида и метотрексата у больных РА. В исследование было включено 999 пациентов с активным РА. Все рандомизированные пациенты были разделены на 2 группы: группа больных, получавших лефлуномид (n=501, 100 мг/сут. в течение 3 дней, затем 20 мг/сут.), и группа пациентов, получавших метотрексат (в дозе 10–15 мг/нед.) в течение 52 нед. Установлено, что эффективность лефлуномида, применяемого как 1–й базисный препарат, несколько выше, чем у больных, которым лефлуномид был назначен после приема метотрексата [17, 18]. Анализ исследования US301 (12 мес., двойное слепое рандомизированное контролируемое) показал клинические преимущества лефлуномида (20 мг/сут., нагрузочная доза 100 мг) по сравнению с метотрексатом. Безопасность и эффективность лефлуномида и метотрексата сохранялись в течение 2 лет наблюдения. Лефлуномид статистически значительно превосходит метотрексат в улучшении функционального состояния суставов в соответствии с индексом HAQ DI. Результаты исследования показывают, что лефлуномид является безопасным и эффективным в начальной терапии для активного РА, с клинически устойчивым эффектом в течение 2 лет лечения [19,20]. В другом открытом исследовании [19,20] у 30 больных с ранней стадией РА (длительность болезни менее 1 года) за 18 мес. лечения лефлуномидом в качестве 1–го БПВП ремиссия по критериям ACR была зарегистрирована у 43,3% больных, еще у 26,7% больных было достигнуто 70–процентное улучшение (ACR70), у 16,7% больных – 50–процентное улучшение (ACR50). То есть при назначении лефлуномида в 1–й год болезни развитие хорошего, очень хорошего эффекта и ремиссии зарегистрировано у 86,7% пациентов. Результаты исследования RELIEF продемонстрировали, что комбинация лефлуномида и сульфасалазина позволяет увеличить эффективность терапии РА без ухудшения переносимости лечения. Получены данные о достоверно более выраженном эффекте комбинации лефлуномида (10–20 мг/сут.) и метотрексата (10–20 мг/нед.) по сравнению с эффектом монотерапии метотрексатом при удовлетворительной переносимости комбинации БПВП [6–8]. Особенный интерес представляет опыт использования лефлуномида в сочетании с биологическими агентами, в первую очередь с ингибиторами ФНО–α (табл. 2). Уже сообщалось, что комбинация лефлуномида и инфликсимаба эффективна. К настоящему времени отсутствуют проспективные рандомизированные исследования эффективности и переносимости этой комбинации. Имеется ряд открытых исследований – как проспективных, так и ретроспективных (табл. 2), в которых зафиксирован выраженный эффект применения инфликсимаба в комбинации с лефлуномидом. Ретроспективные исследования свидетельствуют и о приемлемой переносимости, тогда как в проспективных исследованиях данные о частоте побочных эффектов различны. Было высказано мнение, что число аутоиммунных осложнений при комбинации лефлуномида и инфликсимаба (кожный васкулит, волчаночноподобный синдром, церебральный васкулит, синдром Стивена–Джонса) увеличивается у больных, имевших АНФ в сыворотке крови к началу терапии или при его появлении на этапах лечения. Авторы зарегистрировали наличие позитивности по АНФ к началу комбинированной терапии у 12% больных, а к концу – у 75%. Однако количество больных с позитивным АНФ на фоне лечения инфликсимабом увеличивается и при комбинации с метотрексатом. На сегодняшний день показано, что от присутствия АНФ не зависят ни эффективность, ни переносимость комбинации инфликсимаба с метотрексатом или лефлуномидом. Сравнение эффективности комбинации инфликсимаба с лефлуномидом или другими БПВП показало их примерную равнозначность. Некоторое преимущество комбинации инфликсимаба именно с лефлуномидом заключается в длительности сохранения эффекта и даже увеличении числа больных с хорошим эффектом терапии через 18 и 24 мес. лечения. Комбинация инфликсимаба и лефлуномида вызывает большее количество слабых побочных реакций за счет симптомов непереносимости со стороны кожи (кожные реакции являются самым часто возникающим симптомом непереносимости при монотерапии лефлуномидом). Выраженные побочные реакции в результате применения комбинации инфликсимаба с лефлуномидом встречаются не чаще, чем при использовании комбинации с другими БПВП, а тяжелые инфекции – даже реже. Таким образом, можно заключить, что комбинация лефлуномида с инфликсимабом является эффективной; профиль безопасности схож с профилем безопасности применения лефлуномида в виде монотерапии; частые кожные реакции могут приводить к отмене терапии [15,16]. Подводя итог, можно сказать, что лефлуномид (Арава®) эффективен в лечении больных с любой длительностью заболевания. Однако на ранней стадии болезни наблюдаются более быстрое действие, высокая частота выраженного эффекта лечения и клинической ремиссии. Отмечается быстрое развитие эффекта препарата Арава® с достоверным снижением показателей суставного синдрома и лабораторных параметров активности воспаления через 1 мес. лечения, далее эффект лечения нарастает в течение 4–5 мес. Арава® демонстрирует базисную активность, достоверно уменьшая титр РФ, внесуставные проявления РА (в том числе и проявления васкулита), достоверно замедляя темп рентгенологического прогрессирования, а у большинства больных с хорошим и отличным эффектом – останавливая деструктивный процесс.


Литература 1. Мазуров В.И. Современные методы диагностики и лечения ревматических заболеваний // Медицинская иммунология. 2001. Т. 3. № 2. С. 187–193. 2. Scott D.L., Pugner K., Kaarela K. et al. The links between joint damage and disability in rheumatoid arthritis // Rheumatology (Oxford). 2000. Vol. 39. P. 122–132. 3. Cutolo M., Sulli A., Ghiorzo P. et.al Anti–inflammatory effects of leflunomide on cultured synovial macrophages from patients with rheumatoid arthritis. // Ann. Rheum. Dis. 2003. Vol. 62 (4). Р. 297–302. 4. Насонов Е.Л., Чичасова Н.В., Чижова К.А. Перспективы применения лефлуномида в ревматологии // РМЖ. 2004. № 12 (20). С. 1147–1151. 5. Strand V., Cohen S., Schiff M. et al. Treatment of active rheumatoid arthritis with leflunomide compared with placebo and methotrexate. Leflunomide Rheumatoid Arthritis Investigators Group // Arch Int Med. 1999. Vol. 159. Р. 2542–2550. 6. Smolen J.S., Kalden J.R., Scott D.L. et al. Efficacy and safety of leflunomide compared with placebo and sulfasalazine in active rheumatoid arthritis: a double blind, randomised, multicentre trial. European Leflunomide Study Group // Lancet. 1999. Vol. 353. Р. 259–266. 7. Emery P., Breedfeld C., Lemmel E.M. et al. and the multinational leflunomide study group. A comparison of the efficacy and safety of leflunomide and methotrexate for the treatment of rheumatoid arthritis // Rheumatology. 2000. Vol. 39. Р. 655–665. 8. Cohen S., Cannon G.W., Schiff M. et al. Two–year blinded randomized controlled treatment of active rheumatoid arthritis with leflunomide compared with methotrexate. Utilization of Leflunomide in theTreatment of Rheumatoid Arthritis Trial Investigator Group // Arthritis Rheum. 2001. Vol. 44. Р. 1984–1992. 9. Scott D.L., Smolen J.S., Kalden J.R. et al. Treatment of active rheumatoid arthritis with leflunomide: two year follow up of a double blind, placebo controlled trial versus sulfasalazine // Ann Rheum Dis. 2001. Vol. 60. Р. 913–923. 10. Kalden J.R., Schattenkirchner M., Sorensen H. et al. The efficacy and safety of leflunomide in patients with active rheumatoid arthritis: a five–year follow up study // Arthritis Rheum. 2003. Vol. 48. Р. 1513–1520. 11. Scott D.L., Strand V. The effects of disease–modifying anti–rheumatic drugs on the Health Assessment Questionnaire score. Lessons from the leflunomide clinical trials database // Rheumatology. 2002. Vol. 41. Р. 899–909. 12. Scott D.L., Smolen J.S., Kalden J.R. et al. Treatment of active rheumatoid ar–thritis with leflunomide: two year follow up of a double–blind, placebo–controlled trial versus sulfasalasine // Ann Rheum Dis. 2001. Vol. 60. Р. 913–923. 13. Cutolo M., Sulli A., Ghiorzo P. et Al. Anti–inflammatory effects of leflunomide on cultured synovial macrophages from patients with rheumatoid arthritis // Ann. Rheum. Dis. 2003. Vol. 62 (4). Р. 297–302. 14. Osiri M., She A.B., Robinson V. et al. Leflunomide for the treatment of rheumatoid arthritis: a systematic review and meta–analysis. // J. Rheum. 2003. Vol. 30. Р. 1182–1190. 15. Kalden J. R., Antoni C., Alvaro–Gracia J.M. et al. Use of combination of leflunomide with biological agents in treatment of rheumatoid arthritis // J. Rheum. 2005. Vol. 32. Р. 1620–1631. 16. Dougados M., Emery P., Lemmel E.M. et al. Maintenance rate of leflunomide in patients with rheumatoid arthritis: RELIEF 1–year data // Arthritis Rheum. 2001. Vol. 44. Р. 173. 17. Scott D.L., Smolen J.S., Kalden J.R. et al. Treatment of active rheumatoid ar–thritis with leflunomide: two year follow up of a double–blind, placebo–controlled trial versus sulfasalasine. // Ann Rheum Dis. 2001. Vol. 60. Р. 913–923. 18. Cohen S, Weaver A, Schiff M, Strand V. Two–year treatment of active RA with leflunomide compared with placebo or methotrexate // Arthritis Rheum. 2001. Vol. 44. Р. 1984–1992. 19. Yaremenko O.V., Mikitenko A.M. Comparative evaluation of effects of le–flunomide and methotrexate for early rheumatoid arthritis. In Leflunomide. A selection of communications presented at the annual congress of the European League Against Rheumatism. Netherlands, Amsterdam. June 21–24 2006. P. 22. 20. Karateev D., Luchikhina E.L., Nasonov E.L. High frequency of clinical remission in patients with early rheumatoid arthritis treated with le–flunomide. In Leflunomide. A selection of communications presented at the annual congress of the European League Against Rheumatism, Netherlands, Amsterdam. June 21–24 2006. P. 23.
Противопоказания к применению препарата Лефлуномид
Гиперчувствительность к лефлуномиду, печеночная недостаточность, тяжелый иммунодефицит (в том числе СПИД), нарушение костномозгового кроветворения (анемия, лейкопения или тромбоцитопения, не связанные с ревматоидным артритом), тяжелые инфекции, умеренная или тяжелая почечная недостаточность, тяжелая гипопротеинемия (в том числе при нефротическом синдроме), период беременности и кормления грудью, женщины репродуктивного возраста (не использующие контрацептивы в период лечения лефлуномидом и пока плазменный уровень активного метаболита выше 0,02 мг/л), возраст до 18 лет.
Побочные эффекты препарата Лефлуномид
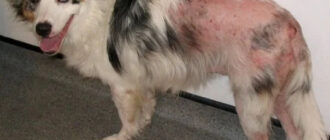
Со стороны сердечно-сосудистой системы: повышение АД. Со стороны ЖКТ: диарея, тошнота, рвота, анорексия, эрозивно-язвенные поражения слизистой оболочки полости рта (афтозный стоматит, изъязвление губ), абдоминальная боль, повышение активности печеночных трансаминаз, особенно АлАТ, реже γ-глутаминтрансферазы, ЩФ, гипербилирубинемия, гепатит, холестастатическая желтуха, печеночная недостаточность, острый некроз печени. Со стороны опорно-двигательного аппарата: тендовагинит; разрыв связок. Со стороны кожных покровов: усиленное выпадение волос, экзема, сухость кожи. Аллергические реакции: сыпь (в том числе макулопапулезная сыпь), зуд кожи; крапивница, мультиформная эритема, злокачественная экссудативная эритема (синдром Стивенса — Джонсона), токсический эпидермальный некролиз (синдром Лайелла); анафилактические/анафилактоидные реакции. Со стороны органов кроветворения: лейкопения, анемия, незначительная тромбоцитопения (тромбоциты менее 100 000/мкл), эозинофилия, панцитопения; менее 0,01% — агранулоцитоз. Лабораторные показатели: незначительная гиперлипидемия, гипоурикемия, повышение активности ЛДГ и КФК, незначительная гипофосфатемия. Прочие: обратимое снижение концентрации спермы, общего количества сперматозоидов и их подвижности; менее 0,01% — развитие тяжелых инфекций и сепсиса.
Лефлуномид – модификатор течения и исходов ревматоидного артрита
Ревматоидный артрит (РА) – основная нозологическая форма воспалительных заболеваний суставов. Теоретическим обоснованием применения при РА болезнь-модифицирующих или базисных противовоспалительных препаратов являются результаты многочисленных исследований, свидетельствующие об иммунном воспалении как основе тканевых изменений. Необходимость их использования обусловлена и хроническим прогрессирующим течением заболевания. В статье рассмотрены вопросы эффективности и безопасности лефлуномида при РА.



Таблица. Сравнительные результаты клинических исследований лефлуномида



Рис. 1. Эффективность лефлуномида по сравнению с метотрексатом в течение двух лет терапии РА



Рис. 2. Эффективность лефлуномида при раннем и позднем РА



Рис. 3. Пятилетняя эффективность лефлуномида по критериям ACR (исследования MN301 и MN302)



Рис. 4. Рентгенологическое прогрессирование РА на фоне терапии лефлуномидом



Рис. 5. Эффективность комбинированной терапии активного РА по критериям ACR
Ревматоидный артрит (РА) относится к самым частым аутоиммунным заболеваниям. Он является основной нозологической формой воспалительных заболеваний суставов. Этиология РА до сих пор не установлена. Для заболевания характерны прогрессирующая деструкция синовиальных суставов и дегенерация хрящей и костей, повреждение связок и сухожилий, системное воспалительное поражение внутренних органов. У больных РА снижаются функциональные возможности и качество жизни. Кроме того, заболевание становится причиной преждевременной смерти [1, 2].
Распространенность РА в разных регионах мира различна – от 0,5 до 2%. В два-три раза чаще им страдают женщины. Пик развития приходится на возрастную категорию от 35 до 55 лет.
По данным эпидемиологического исследования, в России 0,6% больных РА [3].
Патогенез РА мультифакториальный, клинические проявления разнообразны. Необходимо отметить, что РА является идеальной моделью для изучения эволюции и исходов аутоиммунных заболеваний человека, а также для апробации основных групп лекарственных препаратов – от нестероидных противовоспалительных препаратов (НПВП) и глюкокортикостероидов (ГКС) до иммуносупрессоров цитотоксического действия и генно-инженерных биологических препаратов (ГИБП).
Согласно Федеральным клиническим рекомендациям за 2013 г. основная цель фармакотерапии РА – достижение ремиссии (или низкой активности) заболевания (степень рекомендаций A), а также снижение риска коморбидных заболеваний (степень рекомендаций С).
Основное место в лечении РА занимает медикаментозная терапия, включая НПВП, простые анальгетики, ГКС, синтетические базисные противовоспалительные препараты (БПВП) и средства таргетной терапии, в частности ГИБП (степень рекомендаций А).
Теоретическим обоснованием применения при РА болезнь-модифицирующих или базисных противовоспалительных препаратов являются результаты многочисленных исследований, свидетельствующие об иммунном воспалении как основе тканевых изменений. При РА отмечается синтез различных аутоантител, прежде всего ревматоидных факторов и антител к циклическому цитруллинированному пептиду. Необходимость применения БПВП обусловлена и хроническим прогрессирующим течением РА.
К БПВП, которые применяют при РА, относятся цитостатические иммуносупрессоры (метотрексат, циклоспорин А и др.), лефлуномид, сульфасалазин, производные хинолина, препараты золота, микофенолата мофетил, моноклональные антитела к цитокинам и их рецепторам, а также тофацитиниб и апремиласт. Такой широкий спектр препаратов, обладающих патогенетическим действием, обусловлен необходимостью активного воздействия на различные звенья патогенеза.
Терапия заболевания должна проводиться всем пациентам и назначаться как можно раньше – в течение трех – шести месяцев с момента появления симптомов [4] (степень доказательности А).
Так, результаты многочисленных контролируемых исследований показали, что эффективность БПВП тем выше, чем раньше начато лечение.
Кроме того, терапия РА должна быть многолетней и непрерывной. Ее целесообразно продолжать даже при снижении активности заболевания и достижении ремиссии.
Выполнение этих рекомендаций по базовой противовоспалительной терапии позволяет снизить общую стоимость медицинского обслуживания пациентов с РА.
Среди БПВП достойное место занимает оригинальный лефлуномид (препарат Арава), специально созданный для лечения РА. Это единственный БПВП, внедренный в ревматологическую практику за последние 25 лет. Терапевтическое воздействие лефлуномида связано с его активным метаболитом А77 1726 – терифлуномидом. Метаболит ингибирует митохондриальный фермент дегидрооротат дегидрогеназу, который играет важную роль в биосинтезе пиримидина de novo
. Пиримидин необходим для синтеза РНК и ДНК в пролиферирующих клетках. При его дефиците происходит угнетение клеточного цикла.
Главной мишенью терифлуномида являются активированные Т-лимфоциты, однако он воздействует и на метаболизм макрофагов и моноцитов. Лефлуномид блокирует стимулирующее воздействие провоспалительных цитокинов, включая фактор некроза опухоли α (ФНО-α), интерлейкины 1 и 10, интерферон γ, на пролиферацию клона Т-лимфоцитов в завершающей фазе клеточного цикла. В связи с этим препарат можно рассматривать в качестве иммуномодулирующего агента, не обладающего цитотоксическим эффектом.
Среди биологических эффектов лефлуномида при РА выделяют [5]:
- ингибицию пролиферации активированных Т-лимфоцитов;
- блокаду стимулирующего воздействия цитокинов на пролиферацию Т-лимфоцитов;
- ингибицию синтеза пиримидина;
- подавление активности дегидрооротат дегидрогеназы;
- воздействие на экспрессию HLA-DR-позитивных Т-лимфоцитов;
- модуляцию экспрессии провоспалительных цитокинов Т-клетками и нейтрофилами;
- торможение хемотаксиса нейтрофилов;
- супрессию синтеза иммуноглобулина В-лимфоцитами;
- блокаду экспрессии молекул клеточной адгезии;
- ингибицию активации ядерного фактора каппа-би;
- снижение синтеза матриксных металлопротеиназ;
- снижение экспрессии кислородных радикалов;
- торможение синтеза р53 – регулятора негативного клеточного цикла.
Фармакокинетика лефлуномида имеет ряд особенностей. Она линейна, учитывая насыщающую и поддерживающую дозы. Суточная потребность в препарате не зависит от приема пищи, возраста и пола пациента. При одновременном применении лефлуномида и НПВП нежелательные явления препаратов не увеличиваются. При комбинации лефлуномида и метотрексата их фармакокинетика не изменяется, как и при комбинации с преднизолоном или циклоспорином.
Помимо РА лефлуномид применяется при псориатическом артрите, анкилозирующем спондилите, воспалительных заболеваниях кишечника, болезни Шегрена, гранулематозе Вегенера, рассеянном склерозе, злокачественной миастении, нефропатии [6–8]. При псориатическом артрите эффективность лефлуномида была подтверждена PsARC (Psoriatic Arthritis Response Criteria) [8]. Так, к концу шестого месяца терапии PsARC в основной группе составил 58,9%, в контрольной – 29,7%. По окончании лечения число болезненных суставов в основной группе оказалось в три раза меньше, чем в контрольной, припухших – в 1,6 раза меньше.
Лефлуномид статистически достоверно превосходил плацебо по числу больных, достигших ответа на терапию по критериям ACR 20 (American College of Rheumatology). В основной группе таких больных было в 1,5 раза больше, чем в контрольной.
Эффективность лефлуномида в лечении РА продемонстрирована в трех исследованиях [9, 10]. В плацебоконтролируемое исследование US301 были включены 482 пациента с активным РА длительностью не менее шести месяцев. Участники получали лефлуномид 20 мг/день (n = 182), или метотрексат с возрастающей дозой от 7,5 до 15 мг/нед (n = 182), или плацебо (n = 118). Длительность терапии составила 52 недели. В исследовании MN301 (длительность – шесть месяцев) участвовали 358 пациентов с активным РА, получавшие или лефлуномид 20 мг/день (n = 133), или сульфасалазин 2,0 г/день (n = 133), или плацебо (n = 92). Плацебонеконтролируемое исследование MN303 – продленная фаза исследования MN301. Цель – сравнить эффективность лефлуномида и сульфасалазина. Количество участников – 999. В него вошли больные активным РА, получавшие лефлуномид в дозе 20 мг/день (n = 501) либо метотрексат (с увеличением дозы от 7,5 до 15 мг/нед) (n = 498). Продолжительность лечения – 52 недели. Результаты исследований приведены в таблице.
Количество больных с улучшением РА по критериям ACR 20 на фоне терапии статистически достоверно было выше в группе лефлуномида, чем в группе плацебо: 52,2 против 26,3% и 54,6 против 28,6% в исследованиях US301 и MN301 соответственно. По указанному показателю эффективность терапии была стабильной и составляла через шесть месяцев 41% случаев, через 12 месяцев – 49%. Более высокий ответ на терапию лефлуномидом зарегистрирован и по критериям АCR 50 и 70. Так, в исследовании US301 у больных, принимавших лефлуномид, ответ на терапию по ACR 50 зафиксирован в 34,3% случаев, по АСR 70 – 20,2% (против 7,6 и 4,2% случаев среди получавших плацебо).
Интересно, что статистически значимый эффект лефлуномида по критерию ACR 20 у участников исследования US301 отмечался уже через месяц терапии (38% случаев в группе лефлуномида и 20% случаев в группе плацебо). На третьем – шестом месяце он достигал максимума (50–55 и 26–30% соответственно) и практически не изменялся в течение следующих шести месяцев.
Был сделан вывод: достоверных различий в эффективности лечения как между лефлуномидом и метотрексатом, так и между лефлуномидом и сульфасалазином не выявлено. Необходимо отметить, что таковая не оценивалась в зависимости от длительности РА.
Н.В. Чичасова и Е.Л. Насонов ретроспективно, по данным контролируемых исследований, выделили группу больных РА. Длительность заболевания – до двух лет. Оказалось, что через шесть месяцев ответ на терапию по критериям АСR наблюдался у 45,5% больных, получавших лефлуномид, и у 38,8% больных, получавших сульфасалазин [4].
В другом исследовании через 12 месяцев от начала лечения ответ по критериям АСR 50 был зарегистрирован у 34,8% пациентов в группе лефлуномида и у 23,3% – в группе метотрексата. Был зафиксирован очень высокий процент ответа на лечение лефлуномидом – 94 [11].
В открытом исследовании, проведенном в Научно-исследовательском институте ревматологии, показано, что терапия лефлуномидом в качестве препарата первой линии у больных ранним РА (длительность менее шести месяцев) способствовала быстрому развитию клинического эффекта и достижению клинической ремиссии более чем у 40% больных. Последняя сохранялась у большинства пациентов при продолжении лечения [12].
В рандомизированном многоцентровом исследовании (999 больных активным РА) после года терапии ответ на терапию по критериям АСR 20 достоверно чаще регистрировался у больных, получавших метотрексат. Однако через два года различия по данному показателю между группой метотрексата и группой лефлуномида отсутствовали. При лечении лефлуномидом достоверное улучшение по указанным критериям было достигнуто быстрее и наблюдалось в среднем через 74 дня от начала терапии, а при лечении метотрексатом – только через 101 день.
По итогам двухлетнего наблюдения изменение основных клинических показателей воспалительной активности на фоне лечения метотрексатом и лефлуномидом существенно не различалась.
Динамика рентгенологических проявлений в обеих группах была аналогичной.
В то же время при оценке двухлетней терапии активного РА лефлуномидом, плацебо и метотрексатом установлено, что доля больных, ответивших на терапию по критериям АСR 20, при лечении лефлуномидом составила 79%, метотрексатом – 67% [13].
В другом исследовании по оценке эффективности двух основных БПВП, применяющихся при РА, показано, что метотрексат эффективнее лефлуномида (рис. 1) [10]. При сравнительной оценке терапии лефлуномидом и сульфасалазином установлено, что лефлуномид значительно превосходит сульфасалазин по таким параметрам, как функциональный индекс оценки здоровья HAQ (Health Assessment Questionnaire), общая оценка врачом и пациентом и число ответивших на терапию по критериям АCR.
Таким образом, лефлуномид снижает воспалительную активность как при раннем, так и позднем РА (рис. 2). Его эффект устойчив в течение длительного времени – минимум пять лет [14]. При этом не надо увеличивать суточную дозу препарата. Эффективность лефлуномида, как правило, не связана с исходной активностью заболевания, наличием ревматоидного фактора, стадией заболевания. Различия по критериям АСR 20 и 50 на первом и пятом годах терапии практически не наблюдаются. Однако больных, ответивших на терапию по критериям АСR 70 к концу пятого года, оказалось больше, чем в конце первого года лечения (рис. 3).
Таким образом, согласно результатам рандомизированных контролируемых исследований лефлуномид следует рассматривать как высокоэффективный препарат. В результате его применения положительная динамика отмечается более чем у 90% больных РА и гораздо раньше, чем при лечении метотрексатом или сульфасалазином [7]. Так, к концу первого месяца терапии такой ответ наблюдается у каждого третьего пациента, четвертого месяца – у двух третей пациентов. При этом к концу первого года приема лефлуномида клиническая ремиссия фиксируется у каждого третьего больного.
Эффективность лечения РА лефлуномидом в целом сопоставима с эффективностью лечения сульфасалазином и метотрексатом. Лефлуномид превосходит другие БПВП (метотрексат, сульфасалазин, плаквенил) в отношении влияния на качество жизни. Препарат может применяться в комбинации с метотрексатом и ГИБП.
Влияет ли лефлуномид на рентгенологическое прогрессирование РА?
По сравнению с плацебо лефлуномид существенно замедляет рентгенологическое прогрессирование, оцениваемое по приросту эрозий и сужению суставной щели [15]. Достоверных различий влияния лефлуномида или метотрексата на рентгенологическое прогрессирование не получено, однако результаты длительной терапии показали преимущество лефлуномида над сульфасалазином.
Анализ рентгенологического прогрессирования, оцениваемого по методу Шарпа, показал замедление прироста эрозий и сужения суставной щели у больных РА за 12 и 36 месяцев лечения лефлуномидом, а также обратимость костной эрозии [7].
Оценка рентгенологического прогрессирования РА в долгосрочном исследовании у 128 больных, получавших лефлуномид более двух лет, проведена D. van der Heijde и соавт. [5]. Средняя длительность заболевания составляла 5,1 года, лечения – 4,3 года. К началу терапии у 12% больных эрозии зафиксированы не были, у 72% – наблюдался медленный тип рентгенологического прогрессирования РА, у 16% – быстрый. По окончании терапии прогрессирование РА остановлено у 33% больных, что свидетель-ствовало о положительном влиянии лефлуномида на структурные изменения опорно-двигательного аппарата и супрессию заболевания (рис. 4).
Комбинированная терапия лефлуномидом и метотрексатом, лефлуномидом и инфликсимабом очень эффективна, хорошо переносится и может быть рекомендована пациентам, не ответившим на монотерапию БПВП, или при быстром прогрессировании костной деструкции (рис. 5).
Мониторинг больных при комбинированной терапии должен быть тщательным, так как возможно увеличение частоты побочных реакций. При использовании комбинации лефлуномида и ингибиторов ФНО-α не рекомендуются насыщенные дозы лефлуномида (100 мг/сут в течение трех дней), а также одновременноe назначение лефлуномида и ингибитора ФНО-α. При риске развития побочных эффектов или назначении лефлуномида на фоне терапии ингибиторами ФНО-α начальная доза должна составлять 10 мг/сут и увеличиваться до 20 мг/сут в течение двух-трех месяцев [5].
Установлено, что сочетание ритуксимаба и лефлуномида достоверно более эффективно в отношении развития хорошего ответа на лечение по критериям EULAR (European League Against Rheumatism), чем его сочетание с метотрексатом и монотерапия лефлуномидом [16].
Важной составляющей анализа БПВП является оценка их переносимости и безопасности. Переносимость лефлуномида характеризуется как удовлетворительная. По данным исследования TOPAS, на фоне его приема чаще всего наблюдаются такие нежелательные явления, как диарея (13%), гриппоподобный синдром (12,5%), повышение уровня аланинаминотрансферазы (12,5%), головная боль (11,5%), тошнота (9,4%), кожная сыпь (7,3%), повышенная утомляемость/сонливость (6,3%) [17]. В редких случаях отмечались боль в конечностях, мышечная слабость, алопеция легкой степени, фоточувствительность, незначительное повышение артериального давления, транзиторная лейкопения.
Наиболее серьезное осложнение терапии лефлуномидом – повышение печеночных аминотрансфераз и в первую очередь аланинаминотрансферазы. Гиперферментемия чаще всего характеризовалась незначительным увеличением значений аминотрансфераз. Однако у некоторых больных они превышали нормальные значения в три раза и более. Необходимо отметить, что у всех больных нормализация печеночных аминотрансфераз происходила без дополнительных лечебных мероприятий.
Данные о переносимости лефлуномида обобщены в материалах международной конференции «Practical Management of Rheumatoid Arthritis Patients Treated with Leflunomide» (2004 г.) [18]. По мнению экспертов, практически все нежелательные реакции развиваются в первые три месяца лечения. В дальнейшем при использовании той же самой дозы препарата, как правило, не возобновляются.
Диарея у большинства больных разрешается самостоятельно. Полагают, что она является результатом воздействия лефлуномида на клеточный цикл эпителия желудочно-кишечного тракта.
Алопеция – характерный признак интоксикации лефлуномидом – выражена слабо или умеренно и имеет преходящий характер.
Как и при назначении других БПВП, нарушение функции печени развивается в первые три-четыре месяца терапии. Учитывая гепатотоксичность лефлуномида, рекомендуется определять печеночные энзимы каждые две недели в первые шесть месяцев терапии, далее – один раз в два месяца.
При появлении кожных реакций, таких как сыпь или зуд, следует уменьшить суточную дозу препарата или временно отменить его.
Синдром Стивенса – Джонсона (некротический эпидермолиз) встречается крайне редко.
Поскольку при использовании лефлуномида возможно развитие артериальной гипертензии, необходимо проводить мониторинг артериального давления, особенно у больных с гипертонической болезнью. Из гематологических цитопений первостепенное значение имеет нейтропения. При развитии умеренной или выраженной нейтропении лечение лефлуномидом прекращают.
Многие среднетяжелые и тяжелые нежелательные реакции являются дозозависимыми. Их можно избежать, своевременно скорректировав суточную дозу. В частности, не всегда следует назначать насыщающую дозу препарата, поскольку это мало отражается на быстроте развития терапевтического эффекта. В ряде случаев допустимо снижение суточной дозы лефлуномида до 10 мг/сут на протяжении длительного периода.
При развитии выраженных нежелательных реакций необходимо проводить дезинтоксикационную терапию. Наиболее эффективен холестирамин – по 8 г дважды в день. Следует отметить, что спектр нежелательных явлений при многолетнем применении лефлуномида имеет тенденцию к снижению.
Преимущество лефлуномида перед метотрексатом – лучшая переносимость. Так, при применении метотрексата побочные эффекты наблюдаются чаще, носят более серьезный характер и могут привести к летальному исходу. К таковым относятся оральный синдром, мукозит, эпиляция, гематологические девиации, определяющие цитотоксическую болезнь (по интерпретации А.И. Воробьева), токсические явления со стороны центральной нервной системы, остеопатия, аллергические проявления и эндокринные расстройства, а также токсический гепатит, фиброз и цирроз печени.
Таким образом, лефлуномид при РА обладает высокой эффективностью, сравнимой с другими БПВП. При этом заболевании он применяется в качестве монотерапии или в комбинации с другими базисными препаратами, например с метотрексатом или сульфасалазином, а также с биологическими препаратами. Лефлуномид характеризуется не только симптом-модифицирующим, но и структурно-модифицирующим действием. Его целесообразно назначать как на поздних, так и на ранних стадиях РА. Особенностью лефлуномида является устойчивый терапевтический эффект в случае длительного применения (месяцы и годы).
В национальном руководстве по ревматологии за 2008 г. отмечено, что по эффективности лефлуномид не уступает метотрексату и превосходит метотрексат и сульфасалазин по влиянию на качество жизни и быстроте развития лечебного ответа. Согласно рекомендациям ACR, принятым в 2008 г., начинать лечение РА следует с монотерапии метотрексатом или лефлуномидом, независимо от продолжительности, степени активности и наличия признаков неблагоприятного прогноза, в то время как алгоритм лечения РА, разработанный ЕULAR, рекомендует начинать терапию с монотерапии метотрексатом независимо от продолжительности и воспалительной активности и только при его непереносимости в качестве первого БПВП следует использовать лефлуномид [19, 20].
Лефлуномид эффективен в комбинации с метотрексатом и сульфасалазином при недостаточном эффекте монотерапии БПВП, а также с ГИБП. Подчеркивается, что основным показанием к применению лефлуномида являются недостаточная эффективность, плохая переносимость или наличие противопоказаний для назначения метотрексата, в том числе на ранних стадиях РА. Пациентам c ранним РА, имеющим факторы риска неблагоприятного прогноза, высокую активностью заболевания и резистентным к монотерапии метотрексатом, целесообразно назначение комбинированной терапии метотрексатом с другими БПВП – сульфасалазином и гидроксихлорохином и в первую очередь с лефлуномидом.
Особые указания по применению препарата Лефлуномид
Препарат должен назначаться после тщательного медицинского обследования специалистами, имеющими необходимый опыт лечения ревматоидного артрита. Режим дозирования препарата при ХПН легкой степени не определен. Перед началом лечения необходимо помнить о возможном увеличении количества побочных эффектов у пациентов, получавших ранее базисные препараты для лечения ревматоидного артрита, обладающие гепато- и гематотоксическими действиями. Активный метаболит лефлуномида — А771726 характеризуется длительным периодом полувыведения — 1–4 нед. Могут возникнуть серьезные нежелательные эффекты (например гепатотоксичность, гематотоксичность или аллергические реакции), даже при прекращении лечения лефлуномидом. Поэтому при возникновении подобных случаев токсичности или при переходе к приему другого базисного препарата (например метотрексата) после лечения лефлуномидом необходимо проводить процедуру «отмывания»: колестирамин — 8 г 3 раза в сутки в течение 11 дней; в качестве альтернативы — 50 г активированного угля, измельченного в порошок, 4 раза в сутки в течение 11 дней. Сообщалось о редких случаях развития тяжелого поражения печени, в отдельных случаях с летальным исходом, при лечении лефлуномидом, большинство которых наблюдалось в первые 6 мес лечения. Хотя не установлена причинная взаимосвязь этих нежелательных явлений с лефлуномидом, и в большинстве случаев имелось несколько факторов риска, необходимо точно выполнять рекомендации по наблюдению пациентов в процессе лечения. Необходим контроль активности АлАТ перед началом терапии, а затем каждый месяц в течение первых 6 мес лечения, с последующим контролем 1 раз каждые 2–3 мес. Рекомендации по коррекции режима дозирования или прекращению приема препарата в зависимости от выраженности и стойкости повышения уровня АлАТ: при подтвержденном превышении верхней границы нормы АлАТ в 2–3 раза — снижение дозы с 20 до 10 мг/сут (возможно продолжение приема лефлуномида при условии тщательного контроля этого показателя); если 2-, 3-кратное превышение верхней границы нормы АлАТ сохраняется или если имеется подъем уровня АлАТ, превышающий верхнюю границу нормы более чем в 3 раза, прием лефлуномида должен быть прекращен и начата процедура «отмывания». В период лечения рекомендуется воздержаться от приема этанола (повышение риска гепатотоксичности). Полный клинический анализ крови, включая определение лейкоцитарной формулы и количества тромбоцитов, необходимо проводить до начала лечения, а также каждые 2 нед в течение первых 6 мес лечения и каждые 8 нед после завершения лечения. У больных с ранее имевшей место анемией, лейкопенией и/или тромбоцитопенией, а также у больных с нарушениями функции костного мозга или с риском развития таких нарушений возрастает опасность возникновения гематологических нарушений. При возникновении подобного рода явлений следует использовать процедуру «отмывания» для снижения уровня А771726 в плазме крови. При развитии тяжелой гематотоксичности необходимо прекратить прием лефлуномида и любого другого сопутствующего препарата, угнетающего костномозговое кроветворение, и начать процедуру «отмывания». В случае развития язвенного стоматита следует прекратить прием лефлуномида. Сообщалось об очень редких случаях возникновения синдрома Стивенса — Джонсона или токсического эпидермального некролиза у пациентов, получавших лефлуномид. В случае возникновения кожных и/или слизистых реакций необходимо отменить прием лефлуномида и любого другого связанного с ним препарата и немедленно начать процедуру «отмывания» (в подобных случаях оно имеет существенное значение), повторное назначение противопоказано. Препараты, подобные лефлуномиду и обладающие иммунодепрессивными свойствами, повышают риск развития различных инфекций. Возникшие инфекционные заболевания протекают, как правило, тяжело и требуют раннего и интенсивного лечения. При возникновении тяжелого инфекционного заболевания необходимо прервать лечение лефлуномидом и начать процедуру «отмывания». Необходимо тщательно наблюдать за больными с выраженной туберкулиновой реактивностью из-за риска реактивации туберкулеза. Перед началом лечения лефлуномидом и периодически после его начала следует контролировать уровень АД. Отсутствуют экспериментальные данные о риске фетотоксичности при использовании лефлуномида мужчинами. Для максимального уменьшения возможного риска мужчинам при планировании потомства необходимо прекратить прием лефлуномида и использовать колестирамин по 8 г 3 раза в сутки в течение 11 дней или 50 г измельченного в порошок активированного угля 4 раза в день в течение 11 дней. Мужчины, получающие лечением лефлуномидом, должны быть предупреждены о возможном фетотоксическом действии препарата и о необходимости использовать адекватные средства контрацепции. Необходимо убедиться в отсутствии беременности до начала лечения лефлуномидом. В случае подозрения на наступление беременности необходимо незамедлительно сообщить об этом врачу. Врач должен обсудить с больной возможный риск, которому подвергается данная беременность. Быстрое снижение уровня содержания активного метаболита в крови с помощью процедуры «отмывания» препарата при подозрении на беременность поможет снизить риск, которому подвергается плод. В случае если женщина, принимающая лефлуномид, хочет забеременеть, рекомендуется следовать одной из ниже указанных процедур, чтобы удостовериться в том, что плод не подвержен воздействию токсичных концентраций А771726 (контрольная концентрация ниже 0,02 мг/л). Период ожидания: допускается, что концентрация А771726 в плазме крови может быть выше 0,02 мг/л в течение длительного периода. Предполагается, что концентрация может стать ниже 0,02 мг/л через 2 года после прекращения лечения лефлуномидом. После этого необходимо измерить концентрацию А771726 в плазме крови как минимум через 14 дней. Если величина обоих измерений ниже 0,02 мг/л, риск тератогенного действия отсутствует. Далее следует процедура «отмывания». Независимо от выбранной процедуры «отмывания» необходимо провести проверку двумя отдельными тестами с интервалом как минимум в 14 дней. Оплодотворение возможно через 1,5 мес после установления концентрации активного метаболита ниже 0,02 мг/л. Необходимо воздерживаться от зачатия в течение 2 лет после прекращения лечения лефлуномидом. Если период ожидания примерно в 2 года при надежной контрацепции кажется необоснованным, можно провести процедуру «отмывания» в профилактических целях. Возможно снижение контрацептивной активности пероральных противозачаточных средств в результате процедуры «отмывания» с колестирамином или активированным углем. Рекомендуется использовать альтернативные методы контрацепции. В эксперименте показано, что лефлуномид и его метаболиты проникают в грудное молоко.
ЛЕФЛУНОМИД
Особые указания
Препарат должен назначаться после тщательного медицинского обследования.
Усиление побочных явлений может иметь место в случае недавнего или сопутствующего применения гепатотоксичных (включая алкоголь) или гематотоксичных и иммуносупрессивных лекарственных препаратов, или когда прием этих лекарственных средств начинают после лечения лефлуномидом без проведения процедуры «оПрименение при беременности и в период грудного вскармливания».
Перед началом лечения необходимо помнить о возможном увеличении числа побочных эффектов у пациентов, получавших ранее базисные лекарственные средства для лечения ревматоидного артрита, обладающие гепато- и гематотоксическим действием.
Активный метаболит лефлуномида — А771726 характеризуется длительным периодом полувыведения, обычно составляющим от одной до четырех недель. Вследствие длительного периода полувыведения активного метаболита лефлуномида, даже при прекращении лечения лефлуномидом, могут возникнуть и сохраняться серьезные нежелательные эффекты (например гепатотоксичность, гематотоксичность или аллергические реакции). Если развивается серьезное нежелательное явление, или потребуется быстрое выведение из организма А771726 по какой-либо другой причине, следует назначить колестирамин или активированный уголь, как описано в процедуре «оПрименение при беременности и в период грудного вскармливания». Процедуру «ооПротивопоказания»). Не рекомендуется применение лефлуномида пациентам с заболеваниями печени в анамнезе, а также пациентам, у которых активность аланинаминотрансферазы перед началом лечения в 2 раза превышает верхнюю границу нормы.
Сообщалось о редких случаях развития тяжелого поражения печени, в отдельных случаях с летальным исходом, при лечении лефлуномидом. Большинство этих случаев наблюдалось в первые 6 месяцев лечения. Хотя не установлена причинная взаимосвязь этих нежелательных явлений с лефлуномидом, и в большинстве случаев имелось несколько дополнительных факторов риска. Необходимо точно выполнять рекомендации по наблюдению за пациентами в процессе лечения.
До начала лечения, а также, по крайней мере, 1-2 раза в месяц в течение первых 6 месяцев лечения, и в последствии через каждые 6-8 недель, следует проверять активность аланинаминотрансферазы в крови.
Рекомендации по коррекции режима дозирования или прекращению приема препарата в зависимости от выраженности и стойкости повышения активности аланинаминотрансферазы
: при подтвержденном 2-3 кратном превышении верхней границы нормы аланинаминотрансферазы снижение дозы с 20 мг до 10 мг в сутки может позволить продолжить прием лефлуномида при условии тщательного контроля за этим показателем.
Если 2-3 кратное превышение верхней границы нормы аланинаминотрансферазы сохраняется, или если имеется подъем активности аланинаминотрансферазы, превышающий верхнюю границу нормы более чем в 3 раза, прием лефлуномида должен быть прекращен. Для более быстрого снижения концентрации А771726 следует провести процедуру «оПрименение при беременности и в период грудного вскармливания»).
Из-за возможных дополнительных гепатотоксических эффектов рекомендуется воздержаться от приема алкоголя при лечении лефлуномидом.
Гематологические и иммунные реакции
У больных с ранее имевшей место анемией, лейкопенией и/или тромбоцитопенией, а также у больных с нарушением функции костного мозга или с риском подавления функции костного мозга возрастает риск возникновения гематологических нарушений.
Полный клинический анализ крови, включая определение лейкоцитарной формулы и количества тромбоцитов, необходимо проводить до начала лечения лефлуномидом, а также 1 — 2 раза в месяц в течение первых 6 месяцев лечения и затем каждые 6-8 недель.
Частый контроль гематологических показателей (общий анализ крови, включая лейкоцитарную формулу и количество тромбоцитов) должен проводиться в следующих случаях:
— у пациентов с недавно или одновременно принимающих иммуносупрессивные или гематотоксичные препараты, а также при приеме этих препаратов после окончания лечения лефлуномидом без периода «оооооооПрименение при беременности и в период грудного вскармливания».
Взаимодействия препарата Лефлуномид
В настоящее время нет сведений относительно совместного применения лефлуномида с противомалярийными препаратами, используемыми в ревматологии (например хлорохином и гидроксихлорохином), препаратами золота (в/м или перорально), D-пеницилламином, азатиоприном и другими иммунодепрессивными средствами (за исключением метотрексата). Не известен риск, связанный с назначением комплексной терапии, особенно при длительном лечении. Поскольку такого рода терапия может привести к развитию дополнительной или даже синергичной токсичности (например гепато- или гематотоксичности), комбинации данного препарата с другими базисными препаратами (например метотрексатом) нежелательны. Недавнее, сопутствующее или последующее использование потенциально миелотоксичных агентов может быть связано с большей степенью риска гематологических воздействий. Иммунодепрессанты повышают риск развития инфекций, а также злокачественных, особенно лимфопролиферативных заболеваний. Следует соблюдать осторожность при назначении препаратов, метаболизирующихся под действием CYP 2C9 (фенитоин, варфарин, толбутамид), за исключением НПВП. Увеличение выраженности побочных явлений может иметь место в случае недавнего или сопутствующего применения гепатотоксичных или гематотоксичных препаратов или когда прием этих препаратов начинают после лечения лефлуномидом без периода «отмывания». У больных ревматоидным артритом не было обнаружено никакого фармакокинетического взаимодействия между лефлуномидом (10–20 мг/сут) и метотрексатом (10–25 мг/нед). Колестирамин или активированный уголь быстро и значительно снижают концентрацию А771726 в плазме крови. Возможно совместное применение с НПВП и ГКС. Ферменты, участвующие в метаболизме лефлуномида и его метаболитов, точно не известны. Клинически значимое взаимодействие с циметидином (неспецифическим ингибитором цитохрома Р450) отсутствует. После сопутствующего введения однократной дозы лефлуномида на фоне многократных доз рифампицина (неспецифического индуктора цитохрома Р450) максимальные концентрации А771726 возросли примерно на 40%, тогда как AUC существенно не изменилась. Механизм данного эффекта не ясен. Не наблюдается снижения контрацептивного эффекта при совместном применении с трехфазными пероральными противозачаточными средствами, содержащими 30 мкг этинилэстрадиола, при этом фармакокинетика А771726 не изменялась. Нет данных относительно эффективности и безопасности вакцинации на фоне лечения лефлуномидом (не рекомендуется проводить вакцинацию живыми вакцинами). Следует учитывать длительный период полувыведения препарата при планировании вакцинации живой вакциной после его отмены.
Лефлуномид, 10 мг, таблетки, покрытые пленочной оболочкой, 30 шт.
С гепатотоксичными лекарственными средствами и веществами (включая этанол) или гематотоксичными и иммуносупрессивными лекарственными средствами
Усиление побочных явлений может иметь место в случае недавнего или сопутствующего применения гепатотоксичных лекарственных средств и веществ (включая этанол) или гематотоксичных и иммуносупрессивных лекарственных средств, или, когда прием этих лекарственных средств начинают после лечения лефлуномидом без процедуры «отмывания» (см. раздел «Особые указания»).
С метотрексатом
У некоторых (у 5 из 30) пациентов с ревматоидным артритом при одновременном приеме лефлуномида (10-20 мг в сутки) и метотрексата (10-25 мг в неделю) наблюдалось 2-3-кратное повышение активности «печеночных» ферментов в крови, а у других 5-ти пациентов наблюдалось более чем 3-кратное повышение активности «печеночных» ферментов в крови. Во всех случаях эти явления исчезали: у 2-х пациентов при продолжении приема обоих препаратов, а у 3-х пациентов после прекращения приема лефлуномида. Поэтому, хотя, в целом, нет необходимости в периоде ожидания при переходе с приема лефлуномида на прием метотрексата, рекомендуется тщательный контроль активности «печеночных» ферментов в крови в фазе начального лечения после перевода пациента с приема лефлуномида на прием метотрексата.
Вакцинация
Нет данных относительно эффективности и безопасности вакцинации на фоне лечения лефлуномидом. Тем не менее, не рекомендуется проводить вакцинацию живыми вакцинами. При планировании вакцинации живой вакциной следует учитывать длительный период полувыведения препарата после его отмены.
С варфарином
Сообщалось об увеличении протромбинового времени при одновременном применении лефлуномида и варфарина. В клинико-фармакологическом исследовании наблюдалось фармакодинамическое взаимодействие варфарина с А771726 (см. ниже). Поэтому при одновременном приеме с варфарином следует тщательно контролировать МНО (международное нормализованное отношение).
С пищей
Степень абсорбции лефлуномида не нарушается при его совместном приеме с пищей.
Влияние других лекарственных средств на лефлуномид
In vitro исследования, проведенные на микросомах печени человека, подтвердили, что в метаболизме лефлуномида участвуют изоферменты цитохрома Р450 CYP1A2, CYP2C19 и CYP3A4. Клинически значимое взаимодействие с циметидином (неспецифическим ингибитором цитохрома Р450) отсутствует. После сопутствующего введения однократной дозы лефлуномида на фоне многократных доз рифампицина (неспецифического индуктора цитохрома Р450) максимальные концентрации в плазме крови (Сma x ) А771726 возросли примерно на 40%, тогда как площадь под кривой концентрация-время (AUC) существенно не изменилась. Механизм данного эффекта не ясен. Следует иметь в виду возможность продолжения повышения концентраций лефлуномида в крови у пациентов, которые одновременно принимают многократные дозы лефлуномида и рифампицина.
Больным, принимающим лефлуномид, рекомендуется не назначать колестирамин или активированный уголь, поскольку это приводит к быстрому и значительному снижению концентрации А771726 (активного метаболита лефлуномида) в плазме крови. Считается, что это обусловлено нарушением кишечно-печеночной рециркуляции А771726 и/или нарушением его желудочно-кишечного диализа.
Влияние лефлуномида на другие лекарственные средства
Субстраты транспортного белка резистентности рака молочной железы (BCRP).
Хотя наблюдалось фармакокинетическое взаимодействие А771726 с субстратами BCRP (розувастатин) (см. ниже), у 12 пациентов не наблюдалось фармакокинетического взаимодействия между лефлуномидом (10-20 мг в сутки) и метотрексатом (субстратом BCRP; 10-25 мг в неделю).
Не наблюдается снижения контрацептивного эффекта при совместном применении с трехфазными пероральными противозачаточными лекарственными средствами, содержащими 30 мкг этинилэстрадиола, при этом фармакокинетика А771726 не изменялась. Наблюдалось фармакокинетическое взаимодействие противозачаточных средств с А771726 (см. ниже).
С А771726 (главным активным метаболитом лефлуномида) были проведены представленные ниже исследования по фармакокинетическим и фармакодинамическим взаимодействиям. Так как подобные лекарственные взаимодействия не могут быть исключены для лефлуномида при его применении в рекомендованных дозах, представленные ниже результаты и рекомендации исследований следует принимать во внимание у пациентов, получающих лечение лефлуномидом.
Влияние на репаглинид (субстрат CYP2C8)
После повторных доз А7711726 наблюдалось увеличение средних значений максимальной плазменной концентрации (Сmax) и AUC репаглинида (в 1,7 и 2,4 раза, соответственно), подтверждающее, что А771726 является ингибитором изофермента CYP2C8 in vivo. Поэтому рекомендуется проведение наблюдения за пациентами, одновременно принимающими лекарственные средства, метаболизирующиеся с помощью изофермента CYP2C8, такие как репаглинид, паклитаксел, пиоглитазон или росиглитазон, так как при этом возможно увеличение их системной экспозиции.
Влияние на кофеин (субстрат CYP1A2)
Применение повторных доз А771726 снижало средние С max и AUC кофеина (субстрата CYP1A2) на 18% и 55%, соответственно, что подтверждает то, что А771726 может быть слабым индуктором изофермента CYP1A2 in vivo. Поэтому при совместном применении с лекарственными средствами, метаболизирующимися с помощью изофермента CYP1A2, такими как дулоксетин, алосетрон, теофиллин и тизанидин, следует соблюдать осторожность, так как это может приводить к уменьшению эффективности этих лекарственных средств.
Влияние на субстраты транспортера органических анионов 3 (ОАТ3)
После повторных доз А771726 наблюдалось увеличение средних значений С max и AUC цефаклора (в 1,43 и 1,54 раза соответственно), подтверждающее, что А771726 является ингибитором ОАТ3 in vivo. Поэтому при одновременном применении субстратов ОАТ3, таких как цефаклор, бензилпенициллин, ципрофлоксацин, индометацин, кетопрофен, фуросемид, циметидин, метотрексат, зидовудин, рекомендуется соблюдать осторожность.
Влияние на субстраты BCRP и/или транспортирующие органические анионы полипептиды В1 и В3 (OTTPB1/B3)
После повторных доз А771726 наблюдалось увеличение средних значений С max и AUC розувастатина (в 2,65 и 2,51 раза, соответственно). Однако не наблюдалось заметного влияния этого увеличения плазменной экспозиции розувастатина на активность ГМГ-КоА-редуктазы. При одновременном применении доза розувастатина не должна превышать 10 мг один раз в сутки. Для других субстратов BCRP (например, метотрексата, топотекана, сульфасалазина, даунорубицина, доксорубицина) и семейства субстратов белка переносчика органических анионов (ОАТР), особенно ингибиторов ГМГ-КоА-редуктазы (например, симвастатина, аторвастатина, правастатина) следует также соблюдать осторожность при их совместном применении. Пациенты должны находиться под тщательным наблюдением в отношении признаков и симптомов, указывающих на увеличение системной экспозиции этих лекарственных средств, и у таких пациентов следует рассмотреть вопрос об уменьшении дозы этих лекарственных средств.
Влияние на пероральные противозачаточные средства (содержащие 0,03 мг этинилэстрадиола и 0,15 мг левоноргестрела)
После повторных доз А771726 наблюдалось увеличение средних значений Cmax и AUC0-24 этинилэстрадиола (в 1,58 и 1,54 раза соответственно) и Cmax и AUC0-24 левоноргестрела (в 1,33 и 1,41 раза соответственно). Однако не ожидается нежелательного воздействия этого взаимодействия на эффективность пероральных противозачаточных средств, рекомендуется учитывать тип применяемого перорального противозачаточного средства.
Влияние на варфарин
Повторные дозы А771726 не оказывают влияния на фармакокинетику S-варфарина, что указывает на то, что А771726 не является ингибитором или индуктором изофермента CYP2C9. Однако при одновременном применении А771726 и варфарина наблюдалось 25%-ое снижение максимальных значений МНО, по сравнению с таковыми при приеме одного варфарина. Поэтому при одновременном применении с варфарином следует тщательно контролировать МНО.
Другие взаимодействия
Если пациент уже принимает нестероидные противовоспалительные препараты и/или глюкокортикостероиды, их можно продолжать принимать после начала лечения лефлуномидом.
В настоящее время нет сведений относительно совместного применения лефлуномида с противомалярийными препаратами, используемыми в ревматологии (например, хлорохина и гидроксихлорохина), препаратами золота (внутримышечно или перорально), D-пеницилламином, азатиоприном и другими иммунодепрессивными лекарственными средствами (за исключением метотрексата, см. выше). Неизвестен риск, связанный с проведением комплексной терапии, особенно при длительном лечении. Поскольку такого рода терапия может привести к развитию дополнительной или даже синергидной токсичности (например, гепато- или гематотоксичности), комбинации данного препарата с другими базисными препаратами (например, метотрексатом) нежелательны.
Недавнее сопутствующее или последующее использование потенциально миелотоксичных агентов может быть связано с большей степенью риска развития нарушений со стороны крови.
Передозировка препарата Лефлуномид, симптомы и лечение
Данных относительно передозировки лефлуномида или вызванной им интоксикации у человека нет. Показано назначение колестирамина или активированного угля. Колестирамин, принимаемый перорально по 8 г 3 раза в день в течение суток, снижает содержание А771726 в плазме крови примерно на 40% через 24 ч и на 49–65% через 48 ч. Введение активированного угля (в виде суспензии) перорально или через желудочный зонд (50 г каждые 6 ч в течение суток) снижает концентрацию активного метаболита А771726 в плазме на 37% через 24 ч и на 48% через 48 ч.
Список аптек, где можно купить Лефлуномид:
- Москва
- Санкт-Петербург