Причина СМА
СМА — наследственное заболевание, оно связано с мутациями в гене SMN1.
Чтобы болезнь проявилась, носителями мутации в этом гене должны быть оба родителя. Рецессивный ген СМА имеет примерно каждый 40-й. Вероятность рождения больного ребенка от двух носителей – 25%, с такой же вероятностью ребенок двух носителей не будет иметь генной поломки. Ещё в 50% случаев он будет носителем СМА, но сам не заболеет.
В редких случаях (менее 2%) больные дети рождаются в семьях, где носителем является только один родитель. У второго родителя мутация гена происходит при закладке яйцеклетки или сперматозоида.
Если вашему ребенку диагностировали СМА, я хочу поговорить с вами
Что повреждается в результате мутации
Из-за дефектного гена в организме нарушается выработка белка SMN — протеина выживаемости мотонейронов. Без этого белка мотонейроны – нервные клетки спинного мозга, отвечающие за координацию движений и мышечный тонус – отмирают, сигнал в мышцы ног, спины и отчасти рук не идёт.
Без необходимого тонуса мышцы постепенно атрофируются. Отсутствие мышц пресса и спины приводит, кроме прочего, к обширным искривлениям позвоночника, а они – к проблемам с дыханием, которые из-за слабых мышц и так есть.
Болезнь может проявляться с первых месяцев жизни или в более позднем возрасте.



Изображение с сайта bfm.my
Симптомы
Симптомы мышечной атрофии могут варьироваться в зависимости от причины. Тем не менее, наиболее часто наблюдаемые симптомы:
- боль;
- ощущение, что одна конечность меньше другой, например, одна рука выглядит тоньше другой;
- нечувствительность;
- отек;
- мышечная слабость в любой конечности тела;
- трудность выполнения простых движений, таких как сидение или ходьба;
- проблемы с глотанием и речью;
- дыхательная недостаточность;
- мышечные спазмы или тремор;
- проблемы с костями и суставами, такие как сколиоз;
- проблемы координации движений;
- усталость;
- жесткость мышц.
От чего зависит степень тяжести болезни
За выработку белка SMN отвечают два гена — SMN1 и SMN2.
При этом SMN1 – основной «заказчик» данного белка, а SMN2 – дополнительный, он вырабатывает белок в количестве, недостаточном для нормальной работы организма. В случаях, когда в геноме человека SNM1 отсутствует, SNM2 начинает выполнять замещающие функции, но никогда не может полностью восполнить недостачу.
Копий SMN2 в геноме бывает до восьми. От имеющегося у человека числа копий SMN2 и зависит тяжесть состояния больного. Такой сложный механизм болезни приводит к тому, что СМА имеет несколько форм, и состояние больных – очень разное.
Типы мышечной атрофии
Существует 2 основных типа мышечной атрофии, которые различаются по своим причинам. Кроме того, атрофия может затронуть как одну, так и несколько мышц, в зависимости от тяжести и причины.
1. Атрофия из-за недостатка движения.
Это тип мышечной атрофии, при которой потеря мышечной массы происходит из-за недостатка мышечной массы.
Это может произойти из-за чрезвычайно сидячего образа жизни или из-за некоторых медицинских или медицинских состояний, которые мешают кому-либо заниматься физическими упражнениями и даже выполнять простые движения.
Например, люди с ревматоидным артритом или остеоартритом имеют больший риск развития мышечной атрофии, особенно если они никогда не упражняются. Другие медицинские состояния, такие как сломанная кость или сильный ожог (чьё выздоровление происходит медленно) и люди с параличом тела могут стать жертвами мышечной атрофии первого типа.
Какие формы СМА существуют?
Существует 4 типа СМА, различающиеся степенью тяжести и возрастом, в котором впервые проявляется заболевание.
СМА I, болезнь Верднига-Гоффмана. Самая тяжёлая форма болезни, проявляется у младенцев от 0 до 6 месяцев. Дети с этой формой с рождения имеют трудности с дыханием, сосанием и глотанием, а также не осваивают самые простые контролируемые движения — не держат голову, не сидят самостоятельно. Ранее считалось, что большинство (80%) не доживают до двух лет. Сейчас благодаря новым стратегиям ИВЛ и зондовому кормлению срок жизни можно продлить ещё на несколько месяцев.
СМА II, болезнь Дубовица. Первые проявления болезни в 7-18 месяцев. Человек с таким типом СМА может есть и сидеть, но не ходит самостоятельно. Продолжительность жизни зависит от степени поражения мышц, обеспечивающих дыхание.
СМА III, болезнь Кюгельберга-Веландер. Болезнь впервые проявляется после полутора лет. Такие больные могут стоять (испытывая боль), но не ходят. На продолжительность жизни СМА III типа, как правило, не влияет, но сильно ухудшает её качество.
СМА IV, этот тип называется ещё «взрослой СМА», поскольку болезнь проявляется обычно в возрасте после 35 лет. Симптомы – мышечная слабость, сколиоз и тремор. Кроме того, развиваются контрактуры суставов (ограничения подвижности в суставах) и нарушения метаболизма. Прогрессирование заболевания не очень быстрое, сначала мышечная слабость затрагивает мышцы ног, затем – рук. Обычно проблем с глотательной и дыхательной функцией у больных нет. Большинство из больных IV типом СМА могут ходить, и лишь некоторым приходится прибегать к инвалидным коляскам.
СМА, связанные с нарушением гена SMN, в медицинской литературе называют проксимальными — они составляют 95% от всех спинальных амиотрофий. СМА, не связанных с геном SMN, довольно много, но встречаются они редко. К ним относится, например, болезнь Кеннеди. Исследования 1990-х годов показали, что болезнь Кеннеди не связана не с поломкой гена SMN1, но с другими генетическими мутациями, приводящими к нарушению усвоения белка SMN. Болезнь проявляется у людей старше 35 лет. Для СМБА характерна, в основном, слабость конечностей.
Один из видов СМА, не связанный с геном SMN, называется болезнь Кеннеди. То, что эту болезнь до сих пор иногда относятся к СМА – анахронизм. В конце 1960-х, когда было выполнено подробное описание этой атрофии, её посчитали разновидностью СМА, так как при ней поражаются те же нервы и мышцы, что и при трёх типах СМА (но в гораздо меньшей степени).
Адвокат дьявола
Здесь в дело вступает жестокий стратегический расчет. Деньги, которые пациент и его семья отдают за лекарство, должны покрыть не только себестоимость производства десятка миллилитров целебной жидкости и работу медсестры, которая ставит укол. Они должны отбить стоимость разработки этой жидкости — а компания-разработчик, которую позже купила «Новартис», еще в 2021 году декларировала расходы в 360 миллионов долларов. Чтобы «отбить» только их, фармкомпании нужно продать 180 инъекций.
Кроме того, эти деньги должны возместить свои расходы на разработку всех прочих лекарств от той же самой болезни, которые не сумели преодолеть порог клинических испытаний и выйти на рынок. А подобных провальных проектов у компаний обычно немало — в сумме они составляют не меньше 80 процентов среди всех, кто вступает в гонку за одобрение.
Наконец, должно остаться что-то и на будущее: кроме спинальной мышечной атрофии, в мире немало генетических болезней, и логично ожидать, что компания, успешно справившись с одной из них, будет применять свои наработки и для лечения других. А среди них, как всегда, четыре из пяти сорвутся на полпути, не дойдя до финиша.
Создателям «Глиберы» за миллион долларов не удалось за три года продаж заработать даже на то, чтобы «отбить» разработку препарата. Это объяснимо: наследственной недостаточностью липопротеинлипазы страдает примерно 1 человек на миллион, это около семи тысяч покупателей на весь мир. Среди них не нашлось достаточного числа людей с миллионом долларов на терапию. У «Золгенсмы» число потенциальных покупателей на два порядка больше: со спинальной мышечной атрофией рождается один ребенок из 10 тысяч. Однако многие из них не доживают до терапии, а у других нет денег ни на какую медицинскую помощь. И вот из этого баланса «сколько денег нужно, чтобы компания возместила свои убытки — сколько семей смогут заплатить за то, чтобы выжил ребенок» и рождается устрашающая сумма в два миллиона долларов.
Впрочем, есть и другое соображение. Производители лекарств назначают цену, потому что знают, что люди будут готовы ее заплатить. По словам представителя Института клинико-экономической экспертизы США, к моменту одобрения «Золгенсмы» страховые компании были готовы покрыть любые издержки на лечение спинальной мышечной атрофии. Можно долго рассуждать о том, откуда взялась такая решимость и стоит ли сказать спасибо благотворительным фондам, которые поднимают шум вокруг тяжелых болезней (и таким образом якобы поднимают готовность страховых корпораций платить), или научным журналистам, которые в красках рисуют тяготы разработки новых препаратов (и так показывают основания цену не снижать). Но факт налицо: пока эксперты сетуют на то, что постепенное повышение цен на лекарства варит здравоохранение заживо, как лягушку в котле, страховые компании выделяют деньги, пациенты получают свои уколы. Капитализм работает — хоть бы и сопровождаемый заголовками о семизначных суммах за один единственный укол.
Разговоры о том, может ли лекарство стоить так дорого, упираются в рассуждения о ценности человеческой жизни. Дети со спинальной мышечной атрофией первого, самого сурового, типа без лечения редко доживают до двух лет. В редких случаях, когда заболевание протекает мягко, пациентам удается дожить до зрелого возраста — но с помощью аппарата для вентиляции легких и почти полностью парализованными. В такой ситуации выигрыш от лекарства измеряется не отдельными годами, а целыми жизнями.
Стоимость человеческой жизни можно подсчитать формально, опираясь на выгоду, которую каждый гражданин в среднем приносит своей стране, а также субъективные оценки людей, то есть суммы, которые они готовы отдать за безопасность своего существования. Так, американский Институт клинико-экологической экспертизы дает цифры в 100-150 тысяч долларов за год качественной (то есть относительно здоровой и полноценной) жизни. Но поскольку никто пока не знает, сколько именно лет подарит пациентам новая терапия, то ее стоимость Институт оценил в 1,2-2,1 миллиона долларов. Таким образом, «Новартис» в некотором роде оправдал ожидания — пусть и по верхней границе разброса.
Как это лечат?



Изображение с сайта asesoramientopsicologicoalicante.es
В последние годы в мире активно разрабатываются препараты против СМА, три из них уже применяются в мире, остальные находятся на разных стадиях разработки.
Спинраза — препарат, разработанный компанией Biogen, увеличивает производство белка SMN из «резервного» гена SMN2. При регулярной терапии спинраза приостанавливает развитие СМА и стабилизирует состояние больного.
Спинраза выпускается в дозировке 12 мг на 5 мл для интратекального введения (непосредственно в спинномозговую жидкость) и одобрен для всех возрастов и типов СМА без каких-либо ограничений.
В первый год необходимо будет сделать 6 инъекций: 3 дозы с 14-ти дневным интервалом, 1 дозу спустя 30 дней и далее – раз в 4 месяца. Впоследствии препарат нужно будет применять постоянно в течение всей жизни каждые 4 месяца.
Препарат следует начать применять, как только был поставлен диагноз. Эффективность и безопасность применения нусинерсена изучалась у детей в возрасте от 0 до 17 лет, опыт применения у пациентов старше 18 лет ограничен, применение препарата у пациентов старше 65 лет не изучалось.
После применения спинразы наблюдались улучшения двигательной активности у пациентов со СМА I, II и III типа. Возможные осложнения спинразы — инфекция верхних дыхательных путей, инфекции нижних дыхательных путей и запоры, возможно также развитие ателектаза, отклонения коагуляции и тромбоцитопения, включая острую тяжелую тромбоцитопению, а также развитие гломерулонефрита.
13 февраля 2021 года спинраза получила в России орфанный статус. 16 августа 2021 года препарат был официально зарегистрирован в России.
3 августа 2021 комиссия Минздрава рекомендовала правительству включить препарат для лечения спинальной мышечной атрофии в перечень жизненно необходимых и важнейших лекарственных препаратов на следующий год. Однако по состоянию на сентябрь переговоры по возмещению за счет средств федерального бюджета на 2021 год не завершены.
Есть прецеденты выигранных судов, когда суд обязал региональные власти обеспечить пациентов спинразой за счёт региональных бюджетов.
Стоимость препарата – около 8 миллионов рублей за одну инъекцию.
Золгенсма (Zolgensma) — первый препарат генной терапии, разработанный для лечения спинальной мышечной атрофии (СМА). Предназначен для устранения генетической причины СМА путем замены дефектного или отсутствующего гена SMN1 для остановки прогрессирования заболевания. Препарат доставляет полностью функциональную копию гена SMN в организм человека. Препарат разработан компанией Авексис для однократного применения (одна инъекция на всю жизнь).
В настоящее время препарат одобрен в США для больных СМА возрастом до 2 лет, включая тех, кто не имеет симптомов при постановке диагноза. В Европе препарат получают больные СМА I типа с количеством копий SMN2 не более 3 копий, ограничения по весу 21 кг. Препарат вводится однократно внутривенно, доза определяется с учётом массы тела ребёнка.
Наиболее эффективно применение препарата до появления первых симптомов заболевания у детей, у которых наличие СМА установлено по результатам скрининга. Исследования о применении препарата у детей более позднего возраста, уже имеющих симптомы СМА, продолжаются.
Наиболее частыми нежелательными реакциями на фоне применения Золгенсма были повышение активности печёночных ферментов и рвота. В инструкции по применению препарата имеется предупреждение о риске развития тяжёлого острого поражения печени.
В середине июля 2021 года подала в Министерство здравоохранения РФ досье на регистрацию препарата к применению в России. По существующей процедуре, процесс регистрации может занять до полугода.
В настоящее время компанией-производителем объявлена программа сострадательного применения (до официальной регистрации препарата), по которому 100 доз препарата будут распространены между ста пациентами со СМА любого типа до двух лет методом лотереи. В России по этой программе препарат получили 4 ребёнка.
Кроме того, за счёт средств благотворителей препарат получили 16 российских детей, ещё двое принимают участие в программе клинических испытаний.
Стоимость дозы препарата составляет около 152 миллионов рублей (самый дорогой препарат в мире).
Рисдиплам (RG7916) («Эврисди») – препарат компании Roche, является модификатором сплайсинга (генетической модификации) гена SMN2, увеличивающим экспрессию полноразмерных функциональных белков. В отличие от других препаратов, применяется перорально.
Исследования проводились с участием пациентов от 0 до 60 лет со СМА II и III типов. Улучшает моторную функцию пациентов. Противопоказаний на сегодняшний день не зарегистрировано.
18 марта 2021 года подала заявку на рассмотрение для дальнейшей регистрации препарата в Министерство здравоохранения РФ.
В настоящее время производителем открыта программа дорегистрационного доступа к препарату.
Кроме того, в мире идут клинические испытания ещё нескольких препаратов – бранаплам, релдесемтив, SRK-015 и других.
По мнению врачей комбинация препаратов при лечении СМА возможна, но её целесообразность должна рассматриваться в каждом случае индивидуально.
Разработка новых препаратов, направленных на улучшение работы гена SMN2
На данный момент ведутся разработки других препаратов, которые теоретически смогут составить конкуренцию нусинерсену. В целом, все такие лекарственные средства можно разделить на три основные группы:
- Препараты, действующие вещества которых активируют промотор гена SMN2, в результате чего повышается выработка мРНК и, как результат, белка SMN.
- Препараты, направленные на исправление дефектов сплайсинга матричной РНК гена SMN2 (именно к этому типу препаратов относится Spinraza).
- Препараты, направленные на стабилизацию белка, синтезированного по SMN2.
На сегодняшний день известен ряд веществ, таких как вальпроевая кислота, бутират натрия, гидроксимочевина, 4-фенилбутират, некоторые аминокислоты, которые увеличивают продукцию SMN-белка геном SMN2 [4]. Механизм увеличения синтеза белка для многих из этих веществ еще не до конца изучен. На данный момент ведутся исследования эффективности и безопасности указанных веществ при лечении СМА.
До стадии клинических испытаний на пациентах дошел препарат RG7916 (коммерческое название Risdiplam, производитель — швейцарская компания Roche). Это лекарственное средство, как и нусинерсен, относится ко второму типу, если исходить из приведенной выше классификации. То есть препарат модифицирует сплайсинг мРНК SMN2. Его концептуальное отличие от нусинерсена заключается в том, что он вводится перорально или через гастростому, в то время как Spinraza должна попасть непосредственно в спинно-мозговую жидкость [23]. Примечательно, что российские СМАйлики также имеют возможность принять участие в клинических исследованиях, не выезжая за границу, поскольку в Москве открыт центр по программе Sunfish, задача которого испытывать препарат Risdiplam на пациентах со СМА II и III типов. 4 июля 2021 года начали первые скрининги в данном центре [24].
Можно ли помочь больным СМА и как именно?
Вылечить болезнь пока нельзя, но можно облегчать состояние больных СМА, то есть различными способами компенсировать проявления болезни.
При тяжёлых типах СМА больным приходится помогать дышать и глотать. Поэтому им жизненно необходимы мобильные аппараты ИВЛ, аспираторы-откашливатели, мешки Амбу.
Ещё детям со СМА очень нужна помощь волонтёров, способных хоть на короткое время подменить родителей.
Детям, больным СМА, помощь может понадобиться в любой момент, поэтому мамы и папы всегда начеку и сами осваивают навыки реанимации, необходимые на случай, если ребенок внезапно перестал дышать.
Менее тяжёлым больным нужны лекарства, облегчающие дыхание, корсеты, коляски и другие приспособления, облегчающие перемещение и жизнь людей со слабыми мышцами.
Болезнь, продолжающаяся много лет, выматывает, поэтому пациентам, особенно взрослым, часто необходима помощь психолога.



Фото с сайта f-sma.ru
Благотворительный фонд «Семьи СМА» помогает детям и взрослым со спинальной мышечной атрофией и другими нервно-мышечными заболеваниями и их семьям.
Фонд работает по всей территории России. Работа фонда имеет два основных направления — оказание помощи самим больным СМА и их близким и работа на системные изменения ситуации со СМА в России.
Вы можете поддержать деятельность фонда, сделав пожертвование любым удобным для вас способом. Помочь можно, оформив разовое или регулярное пожертвование на специальной странице фонда или отправив на короткий номер 3443 смс со словом СМА и, через пробел, суммой пожертвования — например, СМА 300.
Ольга Германенко: «Болезнь дочери воспринимаю как награду»
Диагностика СМА
Спинальную мышечную атрофию не всегда просто отличить от других нейродегенеративных процессов. Так, к примеру, сходную со СМА этиологию имеют: атонически-астотическая форма ДЦП, миопатия, боковой амиотрофический склероз (именно это заболевание было у известного физика Стивена Хокинга) и др. [9]. И хотя СМА была описана еще в 1890 г., четкие критерии ее диагностики утверждены совсем недавно. Для диагностики СМА используют медико-генетический анализ. Его проведение может производиться как уже после рождения человека путем исследования крови, так и во время беременности путем исследования амниотической жидкости или ворсинок хориона. Также в некоторых случаях проверяют потенциальных родителей на предмет носительства мутировавшего гена.
Можно ли заболеть СМА из-за прививок?
В Европе и США связь между прививками и проявлением болезни не прослежена.
Понять, есть ли связь между СМА и прививками, может объяснение разницы между СМА и полиомиелитом. Полиомиелит – инфекционное заболевание, когда от инфекции повреждается организм изначально здорового ребёнка. Ребёнок со СМА, родившийся с повреждённым геномом, внешне может выглядеть здоровым, но на самом деле он уже болен, просто симптомы его болезни проявляются постепенно. В этом отношении СМА – такая же «отложенная» болезнь как, например, миодистрофия Дюшенна или синдром Ретта, когда ребёнок, некоторое время развивавшийся в соответствии с нормой, теряет приобретённые ранее навыки и становится инвалидом.
Большинство проявлений СМА связаны с освоением первых двигательных навыков. Первые проявления болезни совпадают по времени с несколькими возрастными прививками. В итоге человек и его родные могут утверждать, что он «заболел от прививки», но на самом деле у него просто проявились признаки болезни, которая уже была.
Как определяют, что у ребенка именно СМА, а не какая-то другая болезнь?
Несмотря на то, что впервые СМА была описана австрийским неврологом Гвидо Верднигом и немецким неврологом Джоханном Хоффманном ещё в начале 1890-х годов, полностью понять природу заболевания удалось только в конце XX века. Ген SMN1 был открыт в 1995 году. Чтоб подтвердить диагноз СМА, нужен генетический тест.
В России соответствующие генетические тесты стали доступны в начале 2000-х годов. Генетический тест на СМА возможно сделать по ОМС, однако на практике не слишком много врачей знают этот редкий диагноз и направляют больных на соответствующее исследование. Стоимость такого тестирования в коммерческих лабораториях Москвы – порядка 6 тысяч рублей.
Отсутствие специальной диагностики привело также к путанице в диагнозах. Большинство больных СМА в России не выявлены, у многих выявленных в качестве диагноза записана «болезнь Верднига-Гоффмана», хотя не у всех из них (особенно взрослых) в действительности именно этот тип болезни.
Задавить количеством
Сейчас колесо конкуренции провернулось еще раз: на рынок наконец-то вышел третий препарат — «Эврисди» (Evrysdi, он же рисдиплам) от (Roche). Он работает примерно так же, как и нусинернен — «корректирует» РНК, которая производится с гена SMN2 так, чтобы на выходе получился белок SMN1. Однако, в отличие от своего предшественника, новый препарат — не олигонуклеотидная цепочка, а три соединенных между собой аналога нуклеотидов. Вещество получается гораздо меньше по размеру и более стабильным, что позволяет изменить способ доставки: не вводить в спинномозговой канал (это само по себе больно, а для больных мышечной атрофией, страдающих сколиозом, особенно неприятно) — а пить сироп, что пациент может делать сам, без какого-либо участия врачей.
Какое из лекарств окажется эффективнее, покажет время. На первый взгляд результаты кажутся сопоставимыми: так, около половины детей, которым давали «Эврисди» или кололи «Золгенсму», научились сидеть без посторонней помощи. Долгосрочный прогноз у принимающих эти лекарства пациентов кажется более благоприятным — около 90 процентов выживают в течение года после начала лечения, в то время как для принимающих «Спинразу» эта цифра около 60 процентов. Впрочем, эффект терапии сильно зависит от того, насколько тяжело протекает болезнь у конкретного человека и в каком возрасте его начали лечить.
Цена «Эврисди» зависит от возраста покупателя, потому что дозировка рассчитывается на его массу. Тем не менее, у этой цены есть потолок — 340 тысяч долларов (дозировка на средний вес шестилетнего ребенка). А нижний порог гораздо демократичнее, чем у других конкурентов — всего 100 тысяч долларов в год. Кто знает, возможно, такие цифры для Федеральной антимонопольной службы окажутся более приемлемыми, и российские пациенты со спинальной мышечной атрофией станут клиентами «Роше». По крайней мере, компания уже подала заявку в Минздрав России и рассчитывает зарегистрировать свой препарат в начале 2021 года. На это время действует программа дорегистрационного доступа, по которой несколько детей уже получили свою первую порцию рисдиплама.
Список лекарств от спинальной мышечной атрофии едва ли закончится на трех позициях. Успех первой тройки подстегивает и других игроков на рынке создавать их аналоги. Так, появлялись сообщения о том, что в России разрабатывается свой вариант генной терапии, наподобие «Золгенсмы». С каждым новым препаратом на рынке цена должна падать (если производители, конечно, не договорятся, но для этого и существует ФАС). А после того, как истекает срок действия патента, появляются дженерики, каждый из которых дополнительно роняет цены. Известно, например, что нужно в среднем пять дженериков, чтобы снизить исходную цену лекарства на 95 процентов. С этой точки зрения, не нужно никаких новых технологий, чтобы сделать старые дешевле, достаточно только усердно работать по старым лекалам. Проблему супердорогих лекарств можно просто решить их количеством.
Кто в России помогает людям со СМА и их семьям
Благотворительный фонд «Вера», детский хоспис «Дом с маяком», благотворительный фонд «Детский паллиатив», благотворительный фонд «Семьи СМА», детская паллиативная служба «Милосердие».
С 2014 года в Москве развивается совместный проект службы «Милосердие» и фонда «Семьи СМА» «Клиники СМА» На встречах, которые проходят раз в месяц, больные могут получить консультации пульмонолога, ортопеда, физиотерапевта и психолога. В последнее время часть встреч ориентированы и на нужды взрослых пациентов.
Как предотвратить атрофию
Поскольку мышечная атрофия может возникать и в пожилом возрасте, важно знать способы предотвращения истощения мышц.
Лучший совет — вести активную жизнь. Недостаток физической активности является одним из основных факторов, способствующих атрофии мышц. Поэтому больше занимайтесь спортом, занимайтесь силовыми тренировками не менее 2 раз в неделю, плавайте, танцуйте, бегайте, гуляйте с домашним животным в парке. Важно почаще двигаться!
Другой важный совет — правильно питайтесь. Ешьте натуральные продукты. Это поможет не только сохранить мышцы здоровыми, но и остальную часть тела.
Известные люди со СМА



Валерий Спиридонов. Фото с сайта mioby.ru
Итальянка Симона Спиноглио родилась с наследственным заболеванием – спинальной мышечной атрофией 2 типа. Она с самого рождения не может ходить и передвигается только с помощью электрической коляски. Но ее жизнь полна и насыщенна; ничто не может помешать ее стремлению жить. Симона работает на «горячей линии» итальянской Ассоциации «Семьи СМА» (Famiglies of SMA) и помогает детям и взрослым со СМА и другими нервно-мышечными заболеваниями. Также Симона записала несколько популярных в итальянском сообществе СМА песен — о свободе делать то, что ты хочешь, несмотря на болезнь.
Российская певица Юлия Самойлова родилась в городе Ухта (Республика Коми) В возрасте десять лет выступила на благотворительном концерте, после чего была приглашена заниматься пением в местный Дворец пионеров. В пятнадцати лет начала заниматься в городском Доме культуры.
В 2008 году собрала собственную музыкальную группу (распалась в 2010). В 2013 году приняла участие в конкурсе «Фактор А» на телеканале «Россия». Заняла второе место и получила персональную премию Аллы Пугачёвой «Золотая звезда Аллы». В 2021 году из-за недопуска России в конкурсную программу не смогла принять участие в конкурсе «Евровидение». Передвигается на коляске.
Программист из Владимира Валерий Спиридонов. Окончил школу с золотой медалью, затем защитил диплом инженера. В 2015 году Валерий планировал стать участником эксперимента итальянского хирурга Серджио Канаверо по пересадке головы человека (эксперимент был отменен).
Сегодня Валерий — член городской общественной палаты Владимира, эксперт по вопросам доступной среды, а также создатель собственного сообщества «Desire for life», рассказывающего о создании доступной среды и перспективных медицинских проектах. Валерий – участник многих телепрограмм на российском и зарубежном ТВ.
Валерий Спиридонов: «Мне сложно искать с Богом общий язык»
Поддерживающая терапия при СМА и пациентские организации
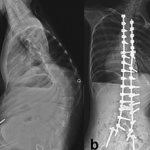
Долгое время лечение СМА сводилось к поддерживающей терапии или паллиативной помощи. Для большинства пациентов постсоветского пространства подход к терапии остается прежним и сейчас, поскольку у них нет доступа к новейшим разработкам в области лечения СМА. Больному рекомендуют умеренные физические нагрузки, такие как лечебная физкультура, занятия в бассейне, которые направлены, в первую очередь, на профилактику контрактур, сколиоза и других вторичных осложнений. При прогрессировании заболевания и развитии сколиоза СМАйликам предлагают операцию по закреплению позвоночника — спондилодез. Такую манипуляцию предпочтительно делать, когда рост позвоночника уже закончен, однако не всегда есть возможность ждать так долго, так как респираторный статус больного может ухудшиться в любой момент [10].
Также больным показано использование технических средств реабилитации, таких как ортопедические корсеты, вертикализаторы, ортезы. При прогрессировании болезни и затруднении при глотании, пациентов кормят через зонд или ставят гастростому. В крайних случаях питание можно вводить внутривенно. Но этот вариант возможен только в стационаре и не рассчитан на длительное время.
Очень серьезная проблема СМАйликов — это слабость респираторных мышц, что приводит к поверхностному дыханию, недостаточному снабжению клеток тела кислородом, сложностями с откашливанием, частым бронхитам и пневмониям. Именно слабость респираторных мышц является основной причиной летальных исходов при СМА.
Для того чтобы контролировать работу дыхательных мышц, СМАйликам рекомендуется выполнять различные дыхательные упражнения, в том числе с использованием мешка «Амбу», дыхательных тренажеров. Если респираторные мышцы уже не могут полноценно справляться со своими задачами, пациентам ставят трахеостому. Также при уходе за СМАйликами зачастую используют откашливатели — аппараты, способные неинвазивно, то есть без проникновения внутрь, удалять мокроту у тех людей, которые не могут ее самостоятельно откашливать.
Все эти методы не влияют на основную причину болезни, но помогают немного сглаживать ее внешние проявления. При этом цена поддерживающей терапии остается очень высокой и неподъемной для многих российских семей. Так, к примеру, один только откашливатель стоит от 85 до 850 тысяч рублей. Если добавить сюда еще стоимость витаминов, аминокислот, занятий в бассейне, ортопедических средств реабилитации, консультации с врачами, то сумма окажется просто астрономической.
Поэтому многие пациенты и их семьи вынуждены обращаться за помощью в различные благотворительные фонды и пациентские организации.
Люди, страдающие различными серьезными патологиями, а также их семьи, очень часто нуждаются в психологической, информационной и материальной поддержке. Для оказания подобной помощи существуют так называемые пациентские организации. «Биомолекула» уже писала о подобных организациях в таких статьях, как «Пациентский активизм и борьба с хроническими заболеваниями» [11] и «Пациентские организации в борьбе с аутоимунными болезнями» [12]. Не удивительно, что для СМАйликов и их родных также существуют подобные организации. Среди них: Cure SMA и SMA Foundation в США, FundAME в Испании, Initiative — Forschung und Therapie fuer SMA Deutsche Gesellschaft fuer Muskelkranke и SMA Deutschland в Германии, SMA Trust в Великобритании, Meier Advocacy & Support Center for SMA в Китае. Также подобные организации существуют в Италии, Израиле, Турции, Польше, Румынии, Украине и многих других государствах. Есть и общеевропейская — SMA Europe.
Среди российских организаций следует о.
Такие организации информируют СМА-семьи о последних разработках в области терапии заболевания, о возможности участия в клинических испытаниях, ищут спонсоров и за их счет помогают частично оплатить расходы на реабилитацию, покупку необходимых лекарственных средств и аппаратуры, а также проводят обучение родителей пациентов, организуют различные мероприятия, которые призваны сделать жизнь СМАйликов более комфортной и долгой, а медицинскую помощь более доступной. Так, к примеру, только за последний год в России и странах ближнего зарубежья были проведены такие мероприятия как SMA Conference 2021 в Варшаве, Конференция по вопросам помощи больным спинально-мышечной атрофией 2021 и «Клиника СМА» в Москве, ProSMA в Харькове и многие другие.
Радикальный способ лечения СМА — пересадка головы
Для борьбы с заболеванием некоторые СМАйлики готовы решиться на крайние меры. Так, к примеру, пару лет назад бурно обсуждался (да и сейчас еще обсуждается, но с меньшей интенсивностью) проект итальянского хирурга Серджио Канаверо (рис. 8). Он заявил, что владеет технологиями, позволяющими пересадить человеческую голову от одного тела к другому, при этом, если все пойдет по плану, пациент останется жив (тот, который согласится любезно предоставить свою голову) и сможет пользоваться новым телом.



Рисунок 8. Серджио Канаверо рассказывает о своем проекте по пересадке головы
кадр из выступления хирурга на TED
Многие врачи назвали его заявление шарлатанством. Однако операция была назначена на декабрь 2021 года. Но была ли она проведена — не ясно. Одно время появилась информация о том, что в ноябре 2021 была сделана «тренировочная» пересадка головы от трупа к трупу, а само масштабное действо на живом человеке перенесено, но на какую дату — неизвестно [13]. Вообще, многие подробности, связанные с таким эпохальным событием, держатся в тайне и поэтому обрастают слухами [14].
Но зато точно известны люди, которые согласились стать добровольцами для данной операции. Первым кандидатом был российский программист Валерий Спиридонов, страдающий СМА. Однако вскоре у него появился конкурент из Китая. Серджио Канаверо отдал предпочтение китайскому претенденту, так как Поднебесная, активно развивающая у себя такое направление медицины как трансплантология, готова была предоставить площадку для проведения операции и поучаствовать материально. Россия же скромно молчала и никак не реагировала на то, что один из ее граждан собирается дать разрешение на отрезание своей головы и обзавестись новым телом. К слову сказать, конкурент Валерия Спиридонова почти в два раза его старше. Поэтому, учитывая способности организма к регенерации в разном возрасте, разумнее было бы взять в качестве добровольца именно Валерия. Но скандальный хирург решил по-другому.
С научной точки зрения оценить эту инициативу очень сложно. С одной стороны, Серджио Канаверо заявил об использовании двух принципиально важных инноваций при проведении операции: это нанонож из нитрида кремния, который должен обеспечить меньшую травматизацию спинного мозга, и полимер полиэтиленгликоль, который должен послужить чем-то вроде биоклея и позволить нервным волокнам донора и реципиента срастись без образования рубца. Однако даже если эти задачи будут решены успешно, существует еще множество проблем в области иммунологического конфликта, реабилитации пациента, его психологического здоровья. А если учесть еще и вопросы биоэтические и юридические [15], то инициатива Канаверо кажется и вовсе чем-то фантастическим. Однако следует помнить о том, что все привычные для нас сегодня вещи и явления когда-то были чем-то запредельным и недосягаемым. Так что, возможно, Серджио Канаверо нас еще удивит.
Подробнее о проекте по пересадки головы от человека к человеку читайте в статье «Голова профессора Канаверо» [16].